por Víctor Hugo Tomasi
Paul Ehrlich (1879) fue el primero en teorizar sobre los mecanismos de la tinción histológica al informar que tanto los colorantes como los componentes del tejido debían presentar sitios cargados eléctricamente y que sería natural que interactúen por unión iónica. Sin embargo, el investigador fundamentalista Gustav Mann (1902) puntualizó que los métodos de tinción sólo tienen importancia cuando permiten observar y analizar las diversas estructuras del tejido y agregó que aquel concepto general no puede constituir la base teórica de las coloraciones, debido a la gran variabilidad molecular que hay en el tejido y al escaso avance teórico que la química había desarrollado hasta entonces, por falta de precisión metodológica.
Por este motivo, si bien la mayoría de los trabajos publicados a partir de aquel momento, sólo informaron sobre el desarrollo de la técnica de coloración y la importancia de su aplicación, algunos pocos investigadores se atrevieron a publicar, además del método de coloración, la fundamentación sobre el posible mecanismo físico-químico producido durante la unión colorante-tejido. Recién en 1958, John R. Baker publicó su libro titulado “Principles of Biological Microtechniques”, en el cual transcribe sus experiencias y la de autores de gran prestigio tales como H. J. Conn, R. D. Lillie, L. Lison, W. C. Holmes, entre otros, para explicar con gran precisión, los mecanismos de la coloración y su relación con los diferentes métodos de fijación biológica, retomando al mismo tiempo, el viejo concepto de Ehrlich para decir:
“La molécula colorante presenta un sitio químico, sea no polar o con carga positiva o negativa, a través del cual se une al componente tisular, mientras que los constituyentes del tejido presentan un átomo o grupo de átomos reactivos que interactúan con las cargas existentes en la molécula colorante en condiciones particulares de pH, concentración, temperatura y tiempo de exposición…”
En la actualidad, el abordaje teórico de la coloración histológica ha cambiado de enfoque, ya que se sabe que los mecanismos de tinción se producen no solo por aquellos factores y condiciones, sino que dependen también, de la geometría y tamaño del colorante, del número y posición de grupos funcionales que éste presenta y de otras fuerzas intermoleculares, entre el colorante y las macromoléculas del tejido, tales como puentes hidrógeno, dipolo-dipolo, fuerzas de dispersión, etc., (Prentø 2001, Horobin y Kiernan 2003). De esta manera, es de fundamental importancia conocer los conceptos teóricos que giran en torno a uniones químicas, fuerzas intermoleculares y propiedades del solvente en el cual se disuelve el colorante, con el propósito de entender cómo estos factores intervienen en la coloración biológica.
Iónica: La propiedad de los átomos para perder o ganar electrones, establecida cuantitativamente por su energía de ionización y afinidad electrónica, explica la transferencia de electrones de unos átomos a otros con la consiguiente formación de iones, cuya atracción electrostática da lugar al correspondiente compuesto (por ejemplo, el Cloruro de sodio: Clº + Naº = Cl- + Na+ = ClNa). Los iones positivos (cationes) y negativos (aniones) que se originan durante la transferencia de electrones, se atraen hasta que la repulsión mutua entre los propios núcleos y sus envolturas electrónicas compensa la fuerza atractiva entre ellos.
La fuerza de atracción “F” es dependiente de la carga y la distancia que las separa, pero independiente de la posición en la que se encuentra. Así por ejemplo, el Azul de toluidina (CI 52040) presenta una carga positiva, mientras que el Azul de alciano (CI 74240) contiene cuatro, por tanto, es de esperar que éste último tiña más rápido grupos tisulares negativos, debido a la mayor fuerza de atracción producida. A esto se refiere con que la fuerza es dependiente de la carga. En la práctica, sin embargo, la tinción se produce en menor tiempo con el Azul de toluidina, ya que tiene bajo peso molecular (p.m. 305,832.). Aquí es evidente que influye el tamaño del colorante. Para acelerar el tiempo de coloración con el Azul de alciano (p.m. 1265,325) es necesario concentrar la solución colorante, a fin de disminuir la distancia que separa dicho colorante del componente tisular. No es casual que el Azul de alciano se prepare en solución saturada y que el tiempo de tinción sea 30 minutos.
Por otra parte, el disolvente también afecta la atracción o repulsión mutua de las cargas y esto se vincula con la Constante Dieléctrica “ε” del disolvente (en el aire o al vacío, ε = 1; en los disolventes no polares, ε = 1-2; en etanol, ε = 23 y en el agua, ε = 79). En solución acuosa, la fuerza de atracción o repulsión entre el colorante y el tejido se puede expresar de la siguiente forma:

De esta manera, la atracción mutua de los grupos químicos cargados entre el tejido y el colorante en solución acuosa es débil y, en la mayoría de los casos, dicha atracción contribuye muy poco en la unión entre un ión colorante y el grupo reactivo tisular. El medio acuoso, más bien, favorece la solubilidad de las moléculas que van a interaccionar, mientras que la unión final estará dada por fuerzas no polares y puentes hidrógeno, potenciados por el efecto hidrofóbico.
Una vez que las moléculas se han aproximado lo suficiente, los grupos cargados pueden interactuar asegurando la selectividad de la coloración biológica. Un ejemplo de lo mencionado se puede ver en las soluciones de Eosina (CI 45380) acuosa versus alcohólica. En el primer caso, la constante dieléctrica del agua es tan elevada (79) que el resultado de tinción es muy débil (rosa pálido) si lo comparamos con una solución etanólica, a igual concentración y tiempo de exposición. La constante dieléctrica del etanol es mucho menor (ε = 23), por tanto, la fuerza de atracción entre el colorante y el tejido será mayor y la tinción se producirá con mayor efectividad.
Covalente: Este enlace se origina cuando dos átomos de afinidad electrónica igual o cercana comparten un par de electrones y se produce por la tendencia de los átomos a adquirir una estructura electrónica estable, que se satisface únicamente por la cesión parcial de un electrón de un átomo al otro (por ejemplo, en el metano: CH4). La unión covalente se designa como covalencia normal para diferenciarla de la covalencia dativa o coordinada en la que uno de los átomos proporciona los dos electrones del enlace (por ejemplo, en el Amonio: NH4+).
La unión de la Fucsina básica (CI 42500) a los grupos aldehídos del tejido, obtenidos tras oxidación suave del corte histológico con ácido peryódico en la técnica de PAS (McManus, 1946), se produce por unión covalente normal. Aquí, el grupo sulfínico del derivado ácido di-N-sulfínico, componente esencial del Reactivo de Schiff, se une covalentemente al átomo de Carbono del grupo aldehído tisular, originado tras dicha oxidación. El siguiente esquema muestra la unión entre la Fucsina básica y el átomo de carbono de un carbohidrato tisular (por ejemplo, glucógeno):

Metálica: La unión entre los átomos metálicos en un cristal puede explicarse por la resonancia de los enlaces covalentes posibles entre todos los átomos que rodean a cada uno de ellos. Esta unión se origina entre átomos metálicos electropositivos o de muy pequeña electronegatividad (por ejemplo, la Plata metálica: Agº). Los iones positivos se mantienen unidos por los electrones de valencia que forman enlaces covalentes entre todos los átomos del cristal precipitado. Las impregnaciones argénticas son un ejemplo donde se producen cristales por unión metálica que se precipitan sobre un componente tisular predeterminado (fibras reticulares: Técnica de Bielchowsky; espiroquetas: Warthin-Starry; neuronas: Cajal; calcio: von Kossa, entre otras).
Fuerzas Intermoleculares
Puente Hidrógeno: es una fuerza que se origina por atracción electrostática entre el protón combinado de una molécula y un par de electrones solitarios de un átomo muy electronegativo y de volumen pequeño, tales como nitrógeno u oxígeno, los cuales forman parte de otra molécula cercana. Por ejemplo, durante la tinción del amiloide con el rojo Congo, los átomos de hidrógeno de los grupos aminos del colorante originan puntes hidrógeno con áreas particulares de la proteína en lámina ß plegada, característica del amiloide. En el siguiente esquema se puede observar la ubicación de los grupos aminos (-NH2) que dan origen a este tipo de enlace cuando interactúan con los átomos de oxígeno localizados en la glicoproteína amiloidea:

Fuerzas Dipolares: la fuerza dipolo-dipolo se origina por atracciones eléctricas entre dipolos moleculares preexistentes. Los enlaces polares se forman por unión covalente entre átomos de moderada diferencia de electronegatividad. En general, esto da lugar a moléculas polares que luego se atraen. Por ejemplo, el Orange G es un colorante planar y presenta grupos sulfonados en su composición, los cuales pueden provocar atracción dipolo-dipolo con grupos peptídicos.

Fuerzas de London: las moléculas no polares, se atraen entre sí mediante interacciones muy débiles del tipo dipolo-dipolo, pero que surgen como consecuencia de dipolos inducidos en una molécula por acción de la otra. En este caso, los electrones de una molécula son débilmente atraídos hacia el núcleo atómico de la otra y entonces, los electrones de ésta son repelidos por los electrones de la primera. En los componentes tisulares con un gran número de sitios no polares (proteínas, ácidos grasos, etc.), estas fuerzas tienen un protagonismo fundamental. En el esquema se representa la forma en que grandes moléculas no polares pueden inducir dipolos para atraerse y, por ello, manifestar cambios geométricos:

Van der Waals: si bien algunos autores indican que dentro de estas fuerzas están las dipolo-dipolo y de dispersión de London (Fessenden & Fessenden 1983), otros, informan que se originan por atracciones eléctricas muy débiles entre átomos polarizados por inducción y esto la diferencia de las fuerzas dipolares. La polarización o deformación eléctrica de aquellos átomos polarizados pierden la simetría de su distribución electrónica al estar las moléculas neutras muy próximas (Babor e Ibarz 1979). Estas fuerzas se pueden presentar durante la interacción de diferentes moléculas colorantes y proteínas tisulares (Sirius red y fibras colágenas). Para que ello suceda, no obstante, las moléculas reactantes se deben aproximar lo máximo posible, a merced de otras atracciones, ya que es la única manera que se promuevan átomos polarizados a partir de sitios neutros.
El mecanismo de coloración es el resultado de la competencia producida entre las fuerzas intermoleculares existentes en el sistema tejido-solvente-colorante. Las uniones entre el colorante-solvente y tejido-solvente se deben cambiar por la unión colorante-tejido.
De esta manera, el solvente participa activamente en el proceso de coloración. El colorante (C) se disuelve en el solvente (S) por la formación de fuerzas intermoleculares (Prentø, 2001):
Asimismo, las moléculas del solvente interactúan con las macromoléculas tisulares (T):
Durante la tinción, las fuerzas intermoleculares favorecen la unión colorante-tejido y cuyo resultado final es:
Por ello, si bien el disolvente se emplea para solubilizar los reactivos colorantes, éste podría intervenir durante la coloración provocando tinciones débiles o inespecíficas. Analicemos un ejemplo, si agregamos 1 gr. de Azul de alciano en 99.5 ml de agua destilada, adicionada con dos gotas de ácido acético glacial (pH 4.5), se colorean suavemente los grupos fosfatos del ADN nuclear, pero si a igual concentración del colorante, colocamos 3 ml del ácido en 97 ml de agua (pH 2.5), los grupos químicos teñidos serán los grupos sulfatos y carboxilos de los proteoglicanos (mucinas). En ambas soluciones, todos los reactivos son los mismos, lo que varía son los volúmenes de agua y ácido. La tinción selectiva de los grupos fosfatos versus los sulfatos y carboxilos se encuentra mediada por el potencial de hidrogeniones que presenta el solvente.
Si el objeto de estudio son las mucinas y la cantidad de ácido acético es insuficiente para lograr el pH 2.5 la tinción será muy débil, mientras que si esa cantidad es aún menor (pH 4.5), la coloración será inespecífica. Esto marca la importancia que tiene preparar soluciones colorantes con las proporciones indicadas en la literatura.
En 1665, Robert Hooke informó sobre sus hallazgos referentes a la composición del tejido, en su texto titulado Micrographia (Royal Society, London), tras observar muestras vegetales diafanizadas con suero glicerinado y donde acuñó el concepto de Célula, debido a que la unidad estructural observada era similar a las "cell" de un panal de abejas. Leeuwenhoek (1714) aplicó por primera vez un agente colorante natural para mejorar la observación microscópica de fibras musculares de mamífero, al emplear una solución alcohólica de “saffron”.
A partir de estas experiencias, otros autores utilizaron diferentes tintes de origen natural a fin de colorear distintos componentes tisulares. Así por ejemplo, Hill (1770) aplicó carmín para la demostración del sistema vascular en plantas, Link (1807) utilizó sales férricas para visualizar el tanino celular en tejido vegetal, Raspail (1825) empleó yoduro para colorear los gránulos de almidón presentes en semillas germinadas, Hartig (1854) coloreó núcleos con phytolocca y Böhmer hizo lo mismo pero con hematoxilina en 1865.
Prout (1855) tuvo la brillante idea de hacer reaccionar los ácidos nítrico y úrico para obtener murexide, primer colorante sintético y Perkin, en 1856, produce un colorante anilínico: el mauve, año en que comienza la producción industrial de distintas anilinas sintéticas.

El color de un agente colorante está relacionado con su estructura molecular y la percepción del color es consecuencia de un conjunto de mecanismos psicológicos y fisiológicos a las radiaciones emitidas por los colorantes, cuando éstas impactan en la retina del ojo. Si las radiaciones de todas las longitudes de onda inciden simultáneamente en la retina se percibe el color blanco. Cuando impacta un rango estrecho de longitudes de onda se observa un solo color y si no se percibe radiación alguna sentimos la sensación de oscuridad…, color negro, ya que ninguna energía fotónica impacta sobre la retina (Berne & Levy 1986, Christie et al. 1999). De esta manera, si la percepción de la imagen coloreada involucra mecanismos fisiológicos y psicológicos interrelacionados, por tanto, del estado funcional de la visión del observador y de cómo tal individuo aprende a determinar y definir un color, comenzaremos por abordar algunos conceptos referidos a visión.
El ojo del ser humano transforma los fotones lumínicos en impulsos nerviosos que llegan al cerebro y dan origen a la visión. Si bien todos los procesos involucrados en la visión, sean físicos, químicos y biológicos no se conocen en su totalidad, se sabe que los bastones y conos de la retina son las células fotorreceptoras de la imagen, la cual se caracteriza por las diferentes “figuras coloreadas” que la componen. Los bastones captan imágenes bajo iluminación débil y la percepción de los colores blanco y negro (visión escotópica), mientras que los conos son las células responsables de la percepción de los colores y de recibir imágenes bajo luz intensa (visión fotópica).
Los bastones detectan la luz a través de un pigmento citoplasmático denominado Rodopsina, la cual se origina por combinación del 11-cis-retinal, un precursor de la vitamina A, con el grupo amino de una proteína compleja llamada Opsina:

Si un cuanto de energía proveniente de una fuente de luz (h·v) incide sobre la rodopsina, se produce una serie de conversiones hasta producir trans-retinal por un lado y amino-opsina por el otro, con introducción de una molécula de agua (el impulso nervioso se genera durante las conversiones intermedias representadas por las metarrodopsinas I y II):

Para que la visión escotópica se mantenga, estos subproductos son reconvertidos por fotoinducción a 11-cis-retinal y opsina y así promover un nuevo ciclo de la rodopsina. En caso que la cantidad de luz sea escasa, el trans-retinal no puede ser fotoinducido con facilidad y, por ello, debe ser reducido enzimáticamente a trans-vitamina A, la cual se transporta al hígado para ser convertida por isomerización a 11-cis-vitamina A y, nuevamente en el ojo, oxidada a 11-cis-retinal para unirse a la opsina y originar la rodopsina.
Estos conceptos se deben tener en cuenta cuando un mismo preparado histológico es analizado por dos o más observadores para la interpretación de una coloración. Existe una manera correcta y tradicional de hacer una coloración adecuada; sin embargo, he observado que un médico anatomopatólogo prefiere que los preparados histológicos teñidos con H&E muestren una eosina más intensa, mientras que otros colegas los prefiere menos brillante (otra analogía relacionada podría ser cuando un observador prefiere ver los preparados con luz fuerte al microscopio pero otros lo hacen con luz más débil). De esto se deduce que cada observador aprecia una tinción mejor en función de sus condiciones fisiológicas, solapadas con la forma en que aprendió a ver una coloración en particular. Esto, no quiere decir que cualquier coloración de H&E sería adecuada y que la interpretación dependa del estado del observador, pues podría suceder que el técnico realice una tinción ineficiente. Lo que se señala es que una buena coloración, libre de artificios de técnica, puede ser bien apreciada o muy apreciada por el observador en función de sus condiciones fisiopsicológicas.
Los compuestos aromáticos tienen una fuerte tendencia a absorber ondas electromagnéticas y dar color. Se supone que existe la posibilidad de cambios rápidos en la configuración de la molécula colorante entre varios estados conformacionales; estos cambios o “resonancia” involucran la absorción de ondas electromagnéticas cuando son tratadas con un haz de luz. Los grupos cromógenos más importantes son:
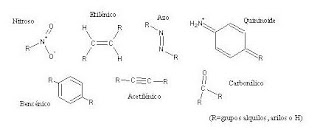
Si nuestros ojos fueran sensibles en luz ultravioleta, el benceno podría aparecer coloreado (a una banda de absorción de 184 nm); sin embargo, es incoloro en el espectro visible. Ahora bien, si incorporamos un grupo químico “azo” entre dos anillos bencénicos, la molécula resultante emitirá color amarillo debido al aumento de las insaturaciones en la misma molécula (mayor cantidad de enlaces no saturados conjugados en el mismo sistema anular) con varias alternativas transicionales π→π*. Ese grupo azo se denomina cromóforo (del griego chroma, “color” y foros, “soportar”):

Asimismo, la presencia de otros grupos químicos unidos al colorante da lugar a una intensificación del color y se denominan auxócromos (del griego auxanein, “aumentar”). En los colorantes de naturaleza básica, los grupos más representativos son los aminos sustituidos primarios, secundarios y el imino:

Muchos de estos colorantes básicos, también llamados catiónicos, presentan carga positiva “delocalizada” (dado por un déficit electrónico), la cual forma parte del sistema cromogénico-aromático. Por ejemplo, el Azur B (CI 52015), que compone la mezcla de Giemsa, presenta un grupo imino cargado:

 En los colorantes ácidos, si bien también pueden presentar grupos aminos pero sin carga, los grupos auxocrómicos más representativos son: sulfínico, sulfónico, carboxilo, hidroxilo y halogénico:
En los colorantes ácidos, si bien también pueden presentar grupos aminos pero sin carga, los grupos auxocrómicos más representativos son: sulfínico, sulfónico, carboxilo, hidroxilo y halogénico: Todos los grupos auxocrómicos mencionados experimentan transiciones n→π* y favorecen, además, la disolución del colorante en medio acuoso. Tal disolución, sin embargo, puede encontrarse entorpecida con otros grupos químicos presentes en la molécula colorante y que, en técnica histológica, se denominan modificadores, tales como metilo, etilo o propilo:
Todos los grupos auxocrómicos mencionados experimentan transiciones n→π* y favorecen, además, la disolución del colorante en medio acuoso. Tal disolución, sin embargo, puede encontrarse entorpecida con otros grupos químicos presentes en la molécula colorante y que, en técnica histológica, se denominan modificadores, tales como metilo, etilo o propilo: Estos grupos modificadores no son solubles en agua pero se disuelven en solventes orgánicos, que incluyen etanol, acetona, éter, metanol, propilenglicol, entre otros, como sucede con los colorantes para grasas, tipo Sudán. Ahora bien, esto no supone que el resto de los colorantes no contengan en su composición grupos modificadores, de hecho se los ha mencionado más arriba. Lo importante es saber que pueden estar presentes e intervenir en la propiedad e intensidad tintorial.
Estos grupos modificadores no son solubles en agua pero se disuelven en solventes orgánicos, que incluyen etanol, acetona, éter, metanol, propilenglicol, entre otros, como sucede con los colorantes para grasas, tipo Sudán. Ahora bien, esto no supone que el resto de los colorantes no contengan en su composición grupos modificadores, de hecho se los ha mencionado más arriba. Lo importante es saber que pueden estar presentes e intervenir en la propiedad e intensidad tintorial.A continuación se esquematizan la Eosina Y (CI 45380) y la Eritrosina B (CI 45430) para determinar cómo un grupo químico puede variar el color. Estos colorantes xanténicos derivan de la fluoresceína por sustitución de sus 4 átomos de hidrógenos con Bromo y Yodo, respectivamente:

Por otra parte y con el propósito de interpretar el mecanismo de acción de una molécula colorante sobre el tejido es necesario tener en cuenta la propiedad que tienen las proteínas, ciertos polisacáridos, pigmentos endógenos y ácidos nucleicos de ionizarse como base o ácido para originar cargas, positiva o negativa, y que muestran afinidad por el colorante. Es decir que, la sola existencia de cargas catiónicas o aniónicas en la molécula colorante no sería suficiente para unirse a los componentes tisulares si estos, a su vez, no presentan cargas opuestas a aquellas.
La ionización ácida de la mayoría de los componentes del tejido se produce en sitios tales como: hidroxilos (-OH), sulfhidrilos (-SH), fosfatos (=PO4H) y, en especial, carboxilos (-COOH). La ionización básica se realiza a través de los grupos aminos (-NH2), generalmente presentes en proteínas y proteoglicanos. En ambos casos, la ionización de esos sitios químicos es dependiente del potencial de hidrogeniones (pH) de la solución colorante.
Las proteínas son macromoléculas que se componen de aminoácidos que se unen originando una cadena lineal (estructura primaria) con grupos laterales funcionales que protruyen hacia ambos lados de la macromolécula, los cuales determinan los plegamientos proteicos, toda interacción y la unión con el colorante. Cada aminoácido contiene en la molécula ambos iones, el carboxilo (-COO-) y el amonio (-NH3+). Por tanto, el aminoácido es anfótero y puede reaccionar con ácidos o bases para originar el catión o el anión correspondiente (Fessenden & Fessenden 1984). En soluciones acuosas, los aminoácidos neutros son ligeramente ácidos, debido a que el grupo amonio es un ácido más fuerte de lo que el grupo carboxilo lo es como base. La diferencia en acidez o basicidad da como resultado que una solución acuosa, por ejemplo, de alanina contenga más aminoácidos en forma de anión que de catión. Por tanto, la Alanina presentaría en tal solución una carga neta negativa:


Los puntos isoeléctricos se determinan por electroforesis y es una Constante Física. Estos puntos varían de un aminoácido a otro, aunque se pueden agrupar en las siguientes categorías:
1. Aminoácidos neutros, como es el caso analizado con anterioridad y cuyo punto isoeléctrico se encuentra entre 5.5 y 6.0.
2. Aminoácidos ácidos, los cuales presentan dos grupos carboxilos y siempre muestran carga neta negativa (punto isoeléctrico próximo a 3.0):
 3. Aminoácidos básicos, los cuales presentan varios grupos aminos y siempre muestran carga neta positiva. Aquí, se requiere la presencia de iones hidroxilos en la solución para neutralizar el aminoácido básico (punto isoeléctrico se halla en el rango de 9.0 a 10.8):
3. Aminoácidos básicos, los cuales presentan varios grupos aminos y siempre muestran carga neta positiva. Aquí, se requiere la presencia de iones hidroxilos en la solución para neutralizar el aminoácido básico (punto isoeléctrico se halla en el rango de 9.0 a 10.8):
Si el pH de la solución colorante está por debajo del punto isoeléctrico de las proteínas, los grupos aminos presentarán carga. De esta manera, las proteínas se tiñen con colorantes de naturaleza ácida: eosina, floxina, fucsina ácida, azul de anilina, orange G, etc. Sin embargo, si esas proteínas están compuestas por gran cantidad de aminoácidos básicos continuarán coloreándose con aquellos colorantes, debido que a si bien la concentraión de hidrogeniones es nula, dichas proteínas siguen presentando carga positiva en algunos de sus grupos aminos, tal como sucede en la tinción selectiva de Eosinófilos. Por el contrario, si el pH es superior al punto isoeléctrico de las proteínas, la ionización se presentará en los grupos carboxilos, los cuales se colorean con colorantes básicos, tales como tionina, pironina, azul de metileno, entre otros.
La propiedad tintorial debe preservarse durante la fijación de la muestra. Un rasgo importante de la estructura de las proteínas es que un grupo lateral particular puede reaccionar químicamente con el fijador en sitios diferentes a los que han de reaccionar con el colorante, sin que se produzcan cambios importantes en la naturaleza de la cadena proteica completa. Si un grupo lateral determinado es capaz de reaccionar con un colorante particular es porque retuvo aquella propiedad cuando se usó un fijador que sólo bloqueó algunos sitios de la cadena lateral. Ahora bien, si teñimos en iguales condiciones, por ejemplo con la técnica de H&E, dos cortes histológicos de un mismo espécimen, pero uno de esos cortes es obtenido a partir de un fragmento de dicho espécimen fijado en formol convencional y el otro corte obtenido del fragmento restante pero sin fijación previa y ambos seccionados en crióstato, observaremos que el último corte muestra una coloración general más intensa de las proteínas eosinófilas en comparación con el corte fijado. Horobin (2002) informó que estos resultados se producen porque la fijación previa provoca en el espécimen una trama reticular entre las proteínas que dificulta la difusión de la molécula colorante. Si bien el concepto es correcto es conveniente considerar que el fijador también puede bloquear algunos sitios químicos laterales de las proteínas, provocando disminución en la intensidad de la coloración. Esto puede observarse, por ejemplo, cuando se colorea un corte histológico previamente tratado con buffer Citrato pH 6.0 en horno de microondas, tal como se emplea en recuperación antigénica. Haciendo una prueba comparativa con dos secciones histológicas adyacentes, coloreadas en idénticas condiciones, la sección pretratada con el buffer citado muestra mayor intensidad tintorial respecto al corte histológico no tratado con microondas (Camarero et al. 2005).
Por otra parte, las proteínas globulares y fibrosas exhiben propiedades y mecanismos de tinción diferentes. Ambos tipos de proteínas pueden, dependiendo del pH, ser coloreadas con tintes aniónicos (acidofilia) o colorantes catiónicos (basofilia). Solamente, la tinción con tintes aniónicos son de importancia práctica, ya que los colorantes catiónicos se reservan para la tinción combinada de ácidos nucleicos y poder observar simultáneamente, además de las proteínas tisulares, los núcleos celulares. No obstante y a diferencia de las proteínas fibrilares, se supone que la mayoría de las proteínas globulares retienen ligeramente sus plegamientos estructurales tras la fijación, deshidratación e inclusión de la muestra. Asimismo, si bien la solución colorante es en si misma desnaturalizante de proteínas y causa su desplegamiento parcial, no afecta demasiado las propiedades tintoriales. Esto se observa también en que los cortes de tejido tanto por congelación como de parafina conservan características colorantes similares.
La coloración de proteínas globulares hecha con soluciones acuosas se lleva a cabo, fundamentalmente, por interacciones hidrofóbicas. El pH bajo empleado en la mayoría de los métodos de tinción promueve el incremento de la repulsión de cargas, durante la cual se abren las estructuras secundarias, aumentando la tensión mecánica de las proteínas inmovilizadas en el corte de tejido. Este pH es determinado, por supuesto, por el disolvente adicionado comúnmente con ácido acético y, posteriormente, una vez producida la unión del colorante aniónico con los residuos no polares disminuye dicha repulsión permitiendo, como consecuencia, que la tensión se alivie y se reestablezcan las estructuras secundarias de las proteínas ya coloreadas. En el siguiente se esquematiza el fenómeno de repulsión de cargas en una proteína hipotética: a pH 7.0 observamos la disposición espacial de la cadena polipeptídica, la cual muestra en sus residuos laterales grupos químicos con carga positiva (+), negativa (-) y grupos no polares (#):

Al sumergir la proteína en una solución ácida (pH 3.0), se produce la siguiente secuencia de eventos:
Como se verá más adelante, en la coloración de proteínas fibrilares además de las interacciones hidrofóbicas, la tinción con colorantes aniónicos también se establece por puentes hidrógeno, ya que en los plegamientos de estas proteínas los grupos peptídicos presentan aminoácidos disponibles para colorantes de elevado peso molecular y más complejos (por ejemplo, Azul de anilina).
En los ácidos nucleicos, la carga neta está determinada por los grupos fosfatos, los cuales se unen a la mayoría de colorantes catiónicos, una vez ionizados. Ejemplos de colorantes catiónicos: hematoxilina, azul de metileno, azul de toluidina, etc. Un caso particular en la coloración de ácidos nucleicos, lo presenta el ADN en la Técnica de Feulgen-Rossenbeck (1924), ya que este ácido se tiñe específicamente por oxidación fuerte de la desoxirribosa con liberación de un grupo aldehído que se colorea con la Fucsina básica de Schiff.
Los lípidos son compuestos fuertemente apolares y presentan sólo algunos escasos sitios polares: carboxilos y fosfóricos, que son insuficientes para producir una coloración intensa. Por ello, se recurre a la naturaleza no polar de los lípidos, utilizando colorantes apolares tales como: Sudán III, Oil Red, Sudán black B, etc. Los hidratos de carbono neutros se colorean tras oxidación previa de sus grupos 1-2 glicoles; mientras que los proteoglicanos se tiñen a través de sus sitios carboxilados y sulfatados con colorantes básicos, tal como sucede con los ácidos nucleicos pero a pH más ácido (0.5 -2.5).
Los mecanismos físico-químicos involucrados en la mayoría de las coloraciones histológicas son aún poco entendidos. Sin embargo, en razón a lo expuesto en párrafos anteriores y al avance de la tecnología en el campo de la Física, la Química y la Informática, se está aplicando desde hace algunos años el Modelo de las Relaciones Cuantitativas de Actividad-Estructura, conocido como “QSAR” (Quantitative Structure-Activity Relationship) para intentar predecir qué componente tisular ha de teñirse con un colorante determinado en condiciones particulares. En la literatura se encuentran numerosos informes sobre el modelo QSAR con aplicación en fisiología olfatoria, toxicología y farmacología, mientras que en histotecnología ya se han publicado algunos trabajos. Horobin (2004) describe con simpleza las características que se deben considerar para emplear este modelo en la coloración biológica y, al respecto, menciona 4 propiedades químicas:
1. La carga eléctrica del colorante (Z).
2. El tamaño del colorante (MWt), el cual hace referencia al peso molecular (lo ideal es trabajar con el tamaño iónico del colorante (IMWt).
3. La afinidad molecular (MA), el cual se relaciona con la hidrofilicidad o hidrofobicidad del colorante con la macromolécula tisular. El valor numérico de esta propiedad se calcula a partir del logaritmo del Coeficiente de Partición (log P) del colorante entre agua-octanol.
4. El número de enlaces conjugados (NUC), el cual representa el tamaño del sistema aromático de la molécula colorante.
En el siguiente cuadro se ejemplifican tres colorantes utilizados en técnica histológica de rutina, en el cual se detallan los parámetros numéricos que caracterizan sus correspondientes estructuras:

Los resultados de coloración pueden ser infructuosos debido a diferentes razones y una de ellas es por el uso del colorante inadecuado. Así por ejemplo, cuando se emplea el Verde rápido C.I. 61570 en vez de C.I. 42053 en la coloración de Gomori para patología muscular, la Fucsina ácida C.I. 17200 en vez de C.l. 42685 en la tricrómica de Masson para diferenciar tejido muscular y conectivo o el Rojo congo C.I. 22150 en vez de C.I. 22120 en la técnica de Benhold para la coloración de amiloide, pueden obtenerse resultados de tinción débiles, inespecíficos o falsos negativos. Por ello, es conveniente recordar que existen diferentes variedades de una misma molécula colorante y que, por supuesto, tienen el mismo nombre.
Estas moléculas, cuyo cromógeno es el mismo, difieren unas de otras en los grupos modificadores y/o auxócromos presentes. Por ello, la Comisión Americana para la Estandardización de Colorantes Biológicos, ha elaborado una lista con todos los colorantes utilizados en Técnica Histológica, identificados con un número, precedido de la sigla C.I. (Colour Index) para cada uno de ellos (Rowe 1924, Conn 1953, Lillie 1977). Por ejemplo, si comparamos los colorantes tipo Orange (CI 16230 vs. CI 15510), tanto la geometría como la cantidad de grupos sulfónicos presentes, intervienen de manera decisiva en la selectividad e intensidad de la coloración de Bensley (1911) para diferenciar células A y B en los islotes de Langerhans del páncreas:

Asimismo, el Colour Index evita el uso de sinónimos empleados para un mismo colorante y que fueron acuñados por diferentes autores en distintos trabajos, sin saber que se trataba de la misma sustancia química. Retomando el ejemplo anterior, el Orange G se lo conoce también como Wool Orange 2G o Crystal Orange GG, mientras que el Orange R es llamado Orange II, Orange extra, Mandarin G o Tropaeolin OOO Nº 2.
Por otra parte, cada colorante tiene un número conocido como CAS (Chemical Abstract Service), el cual permite la correcta identificación de cada colorante en función de todas las sustancias químicas conocidas. En el siguiente cuadro se detallan algunas características que figuran en la etiqueta de un mismo colorante expendido por tres marcas comerciales reconocidas internacionalmente. El Chromeazurol B es también conocido como, Mordant blue 1, Solocrome azurine B, Chromoxane pure B, Chrome fase blue y Azurine B (Lillie 1977). De todos los datos, el CAS "debe" figurar y es el que confirma cuál es la molécula colorante que compramos.

Para comentarios y foros de debate ir a página principal.